外部寄稿
日本は1970年に人口に占める65歳以上の高齢者の割合が7%(約730万人)を突破し「高齢化社会」に突入した。その後、高齢者人口は増え続け2024年1月現在3,600万人を超え、総人口に占める割合(高齢化率)は30%に迫ろうとしている。厚生労働省の推計によると、2042年には65歳以上人口がピークを迎え3,878万人となると予測されている。75歳以上人口も増加の一途をたどり、2057年には人口の4分の1を超えると予測されている。超高齢化社会の到来である。超高齢化社会の一番の課題はいかに健康で長生きするか、つまり平均寿命と健康寿命の差をいかに少なくするかということである。この課題への対応策として、本稿では著者らが見いだした老化に伴い増加する特異なT細胞*1集団(老化関連T細胞、Senescence-Associated T cell:SAT細胞)について、その性状ならびに高齢者になって発症する加齢に関連した疾患との関係を紹介するとともに、SAT細胞をいかに制御して健康寿命の延長につなげるかについて論じる。また本稿最後では、SAT細胞制御に加え、健康寿命の延長に向けて重要となるその他諸課題にも触れ、それらが解決されたときの「真の超高齢化社会」について若干の展望をしてみたい。
平均寿命は、ほとんどの先進国においてこの200年間で2倍になった。その要因として食料事情、衛生環境、住居環境の向上に加え、予防接種の普及ならびに医療技術の進歩が挙げられる。後者の2点により、まず幼少期の死亡率が低下し、それに引き続き1950年ごろから70歳以上の死亡率が減少した。しかし、図1 Aに示すように平均寿命の延長は、いくつかの慢性疾患に同時に罹患(りかん)する割合(多疾患併存率)が加齢とともに増加するという問題を伴っていた。この多疾患併存率の増加が、平均寿命と健康寿命をかい離させる大きな原因だと考えられる。そしてこの多疾患併存率の増加は医療費増加に直結し、社会経済を圧迫するに至った。図1Bは2010年に総務省より発表された代表的疾患の年齢階級別患者数を示すグラフであるが,それぞれの発症原因が全く異なる疾患にもかかわらずその発症時期が非常に似かよっている疾患が多いことに気づく。多疾患併存率の増加は、65歳前後で発症がピークとなる糖尿病や動脈硬化、慢性腎不全などの加齢関連疾患が原因となっている。このように同じ発症パターンを示す要因はいくつか考えられるが、中でも免疫の老化が大きな影響を及ぼしていると示唆されている。
免疫老化は当初、加齢に伴い免疫に関係する細胞、特にT細胞やB細胞といった適応免疫*2を担う細胞の機能が低下する現象として見いだされた。加齢に伴い感染への抵抗力やワクチンの効果が低下し感染症にかかりやすくなったり、がん発症リスクが増加したりするのは、この適応免疫機能の低下によるものである。しかし研究が進むにつれ、免疫老化という現象は単に免疫機能の低下だけではなく、炎症誘発形質の亢進(こうしん)や、自己免疫応答を起こすことが明らかになってきた。炎症を誘発する形質の亢進とは、免疫細胞が病原体を排除するときに生じる炎症が、通常より激しくなり悪影響を与えることであり、また自己免疫応答とは、本来病原体などの異物を排除する免疫が正常な細胞まで攻撃してしまう現象のことで、もともと身体を守るべき機能が逆に身体を攻撃してしまうという、一見逆説的な現象が老化とともに起こっていることが明らかになってきた。そしてこれらの免疫老化による機能亢進ともいえる現象が、加齢関連疾患を引き起こしている。
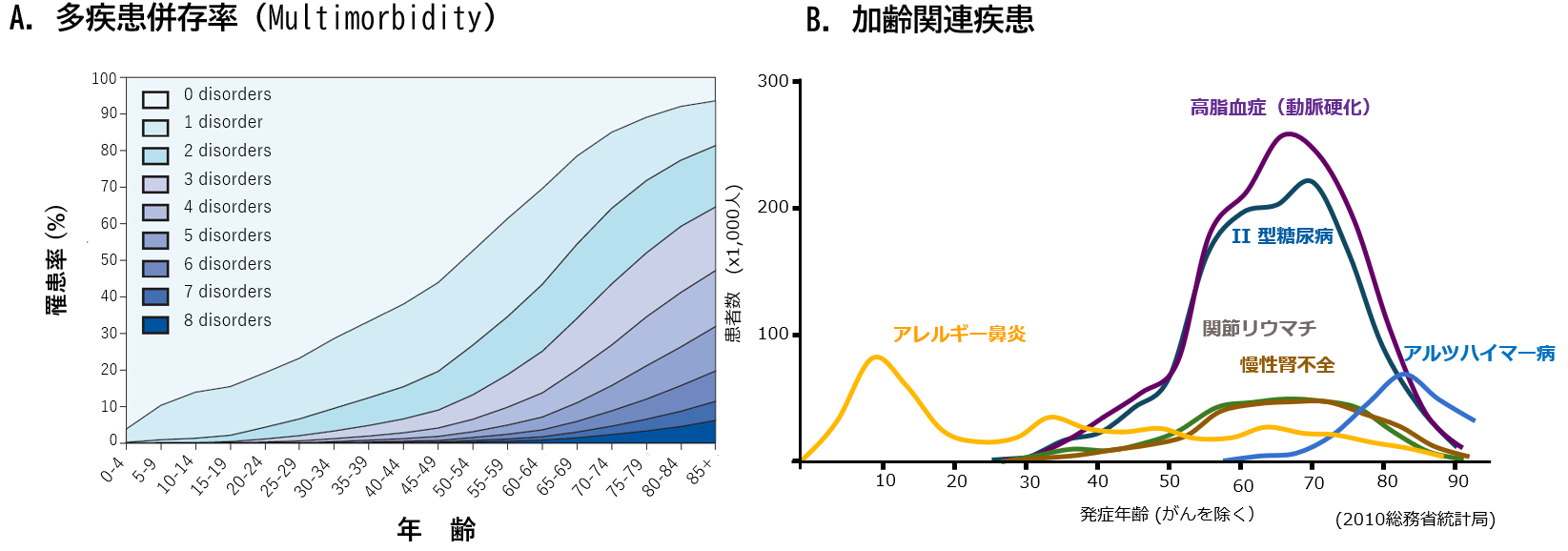
図1-AはLancet(2012), 380, 37-43を引用・改変、図1-Bは総務省統計局(2010)
図1 加齢に伴う多疾患罹患率の増加と加齢関連疾患の発症年齢
免疫細胞の中で加齢により一番大きな影響を受けるのが、免疫の司令塔として機能するT細胞である。これはT細胞を生み出す臓器である胸腺が、加齢に伴い退縮(縮小)するためである。胸腺の退縮は、ヒトでは思春期を境に始まり、次第に退縮して脂肪組織に置換される。この退縮により、胸腺は次第にT細胞を生成できなくなり、その結果、末梢(まっしょう)へ供給されるナイーブT細胞(まだ抗原*3と出会っていないT細胞)が減少する(図2)。一方、末梢のT細胞集団は恒常性増殖*4(Homeostatic Proliferation)という機構により老齢期においても一定数に保たれている。この結果、末梢T細胞集団の構成は、加齢に伴いナイーブT細胞が多い状態から、一度抗原に出会った性状を示す記憶型T細胞が多い状態へと変化する。加齢に伴うT細胞の抗原に対する反応性(免疫機能)を調べてみると、先に述べたように反応性は確かに低下するが、それはすべてのT細胞にあてはまる現象ではない。加齢に伴い割合が増加する記憶型T細胞において、特に反応性が低下することが明らかになった(図3)。このようなT細胞集団の構成変化が新しい抗原に対する反応性の減少につながり、感染への抵抗性やワクチンの効果を下げる。さらに詳細に検討を行った結果、記憶型T細胞のうちCD153という分子を細胞表面に発現するT細胞において、機能低下が顕著であるとともに、細胞老化の特徴を持つことが明らかになった。後述するようにこのCD153+記憶型T細胞*5が加齢関連疾患の発症に深く関与していたことから、われわれはこの細胞を老化関連T細胞(SAT細胞)と命名した。
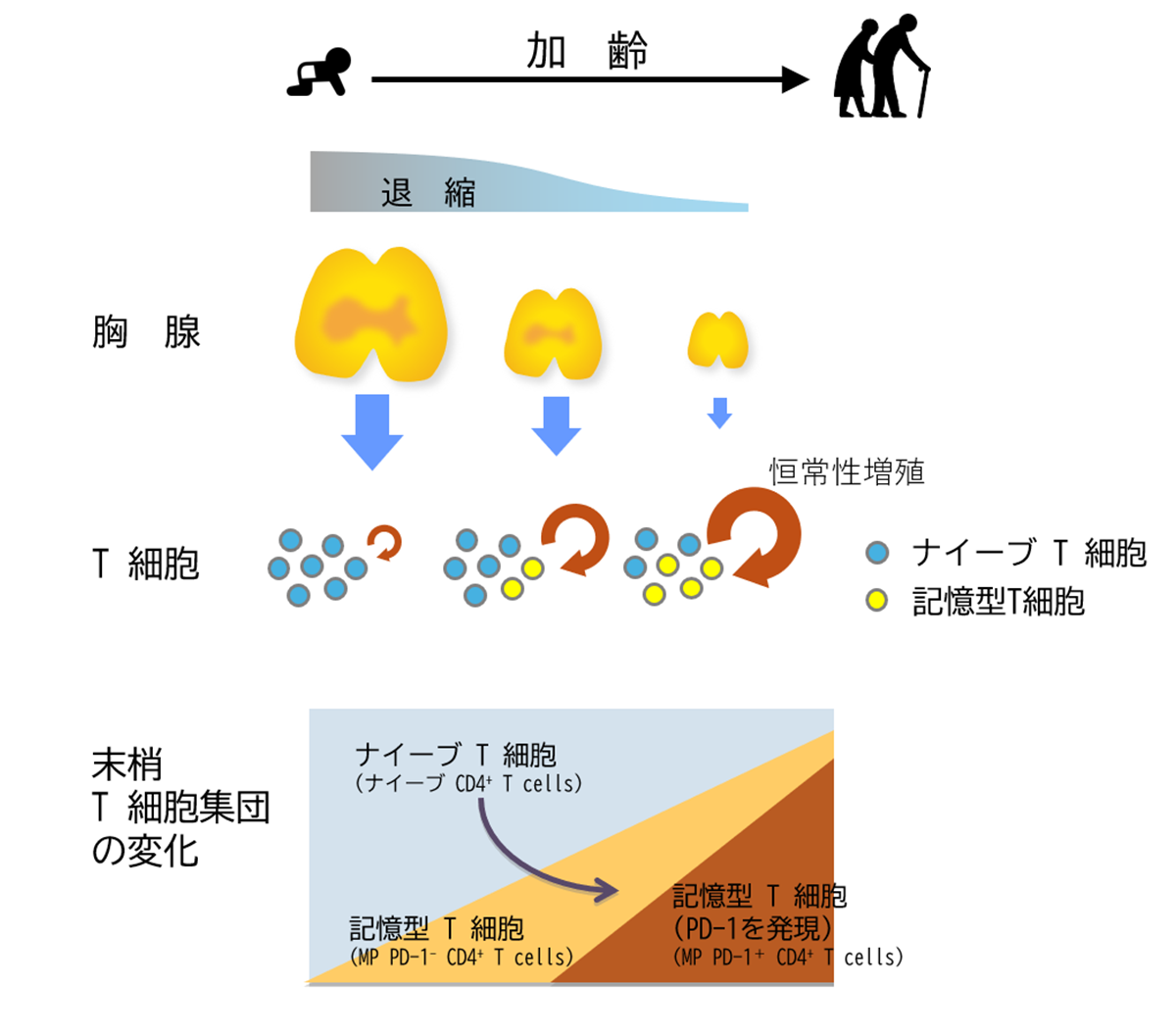
資料:著者作成
図2 加齢に伴う胸腺退縮によるT細胞集団の変化
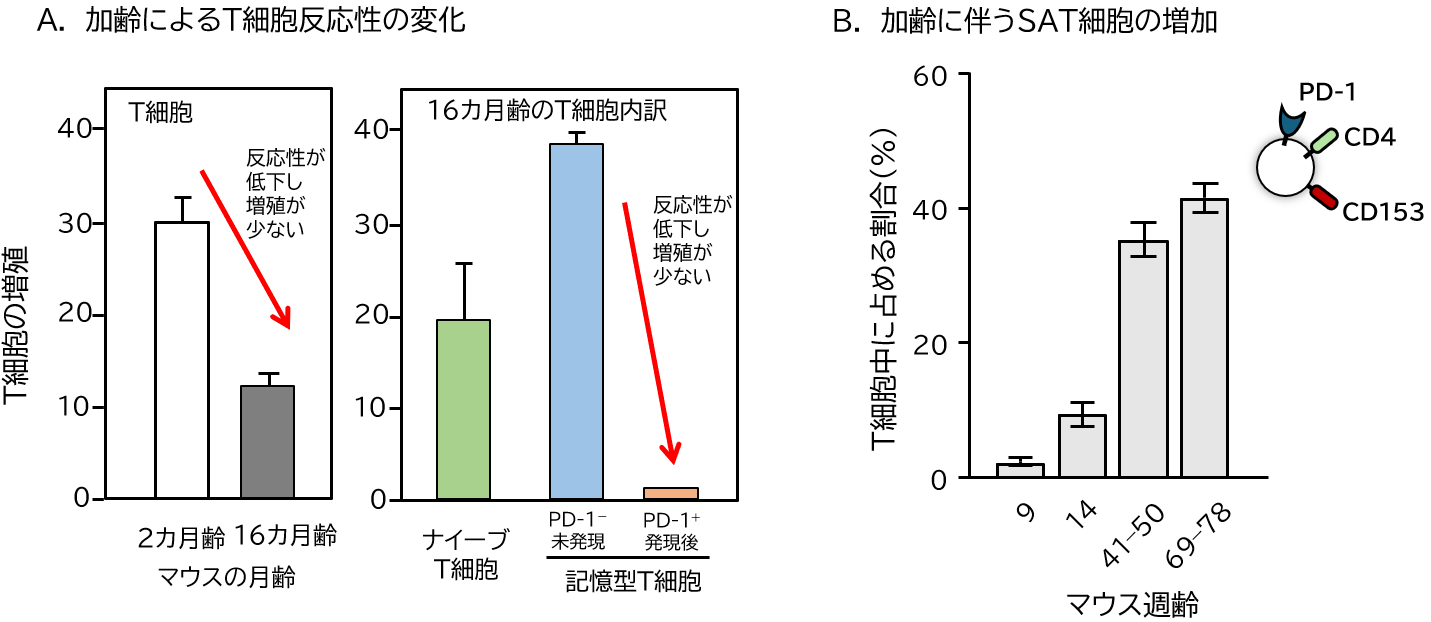
資料:著者作成
図3 加齢に伴うT細胞反応性変化とSAT細胞の増加
T細胞はその機能から大きく二つに分類される。一つはB細胞が抗体を作り出す仕組み(抗体産生機構)を制御するヘルパーT細胞(CD4を発現(+))、もう一つは生体に生じるがん細胞やウイルス感染細胞を直接殺すキラーT細胞(CD8を発現(+))である。加齢とともに増加する記憶型T細胞の大部分がCD4+T細胞であり、SAT細胞もCD4+記憶型T細胞に分類される(CD8+T細胞の加齢による変化については、まだ不明な点が多い)。CD4+記憶型T細胞の特筆すべき点は、がん免疫のチェックポイント分子*6として機能するPD-1という分子を発現することである。ただ、このPD-1がSAT細胞の機能にどのような役割を果たしているかは不明である。いずれにしてもSAT細胞はCD4+の他にCD153+ PD-1+ 記憶型T細胞という表現系を持つT細胞として検出することができる。
生物個体の老化に伴い、われわれの身体を構成する細胞も老化する。あるいは、個々の細胞老化により生物個体の老化がもたらされるといった方が正確かもしれない。この細胞老化という概念は、正常な線維芽細胞*7を試験管内で継代培養し増殖を繰り返した場合に、いつしか増殖が停止してしまう現象として見いだされた*8。老化した細胞を解析すると、p15Ink4b、p16Ink4a あるいはp21WAF/CIP1と呼ばれる、細胞周期(細胞が分裂して増殖する周期)の進行を阻害する細胞周期阻害物質の発現が増え、細胞内で遺伝子が働くことを抑制するヘテロクロマチン構造の形成が見られて、細胞の増殖を停止している。また老化した細胞では細胞老化随伴分泌現象(Senescence-Associated Secretory Phenotype:SASP)と呼ばれる炎症物質の分泌が起こり、周囲の組織に炎症反応を引き起こすことが知られている。SAT細胞を調べてみると増殖機能の低下に加え、p15Ink4bやp21WAF/CIP1の発現が上昇し、ヘテロクロマチン構造が形成され、さらにSASPを彷彿(ほうふつ)させる炎症性因子オステオポンチン(Osteopontin:OPN)というサイトカイン*9を発現する等、細胞老化の兆候を多く示すことが明らかになった。
T細胞は、抗原を認識すると、IL-2というサイトカインを分泌して増殖する。B細胞やB細胞が産生する抗体分子が直接抗原を認識するのに対し、T細胞は、抗原が細胞に取り込まれ分解処理を受けて断片となり、主要組織適合性複合体(Major Histocompatibility Complex: MHC)と呼ばれる分子の上にのせられて細胞表面に発現した状態を、抗原情報として受け取る。この複雑な抗原認識機構により、T細胞は細胞内で起こるさまざまなイベントに対応している。例えば、B細胞や抗体は細胞内で増殖するウイルスをその状態では攻撃できないが、T細胞は細胞内で増殖するウイルス情報をMHC経由で受け取り、ウイルス感染細胞を攻撃することができる。同様にT細胞は、細胞がん化に伴い産生されるがん抗原の情報をMHC経由で受け取ることによりがん細胞を攻撃できる。正常のT細胞はこのようにMHCを経て細胞上に発現する抗原情報をT細胞抗原レセプター(T Cell Receptor:TCR)で受け取ることにより、増殖する。ところが、SAT細胞の場合は抗原からの刺激をTCRから与えても、試験管内ではほとんど増殖反応を起こさない。しかし、老化個体で調べると、間違いなくSAT細胞は生体内で増殖し加齢とともにその割合を増加させている。試験管内で増えないSAT細胞は、いかにして生体内で増えることができるのか。われわれはこのパラドックスに立ち向かい、さまざまな試行錯誤を繰り返し3年ほどかけてようやく答えを得ることができた。
その鍵はSAT細胞が発現するCD153という分子にあった。CD153はTNFスーパーファミリー*10と呼ばれる細胞表面に発現される分子群に属するタンパク分子の一つで、CD30という分子のリガンド*11として機能する(図4A)。つまりCD30という鍵穴にCD153が差し込まれることにより、CD30を発現する細胞内にシグナルが伝達され、その細胞が増殖する仕組みである。このCD30を発現する細胞を調べたところ、特殊なB細胞に発現することが分かった。ここで特殊というのは、ウイルスや細菌といった外来の抗原に反応するB細胞ではなく、加齢に伴い出現・増加する自己の成分(自己抗原)に反応する自己反応性B細胞であった(正確には自己反応性胚中心B細胞と、加齢に伴って出現する老化関連B細胞(Age-associated B Cell:ABC)の2種類のB細胞からなる)。いずれも自己免疫疾患の発症に関与する細胞であり、SAT細胞はCD153-CD30相互作用を介してこれらの自己反応性B細胞の増殖・分化*12を亢進することが明らかとなった(図4B)。一方、SAT細胞ではCD153-CD30相互作用が起こると、CD153が細胞膜上からSAT細胞内に入りTCRと結合し、TCRから細胞内に伝達されるシグナルを強化することが明らかとなった。結果として、通常のTCR刺激では増殖反応を起こさなかったSAT細胞が、TCRシグナルの強化により増殖するようになるのである。つまり両者はCD153-CD30相互作用を介してお互いに増殖のループを回転させ、それぞれの細胞が増幅するという仕組みを持っていたのである(図4B)。
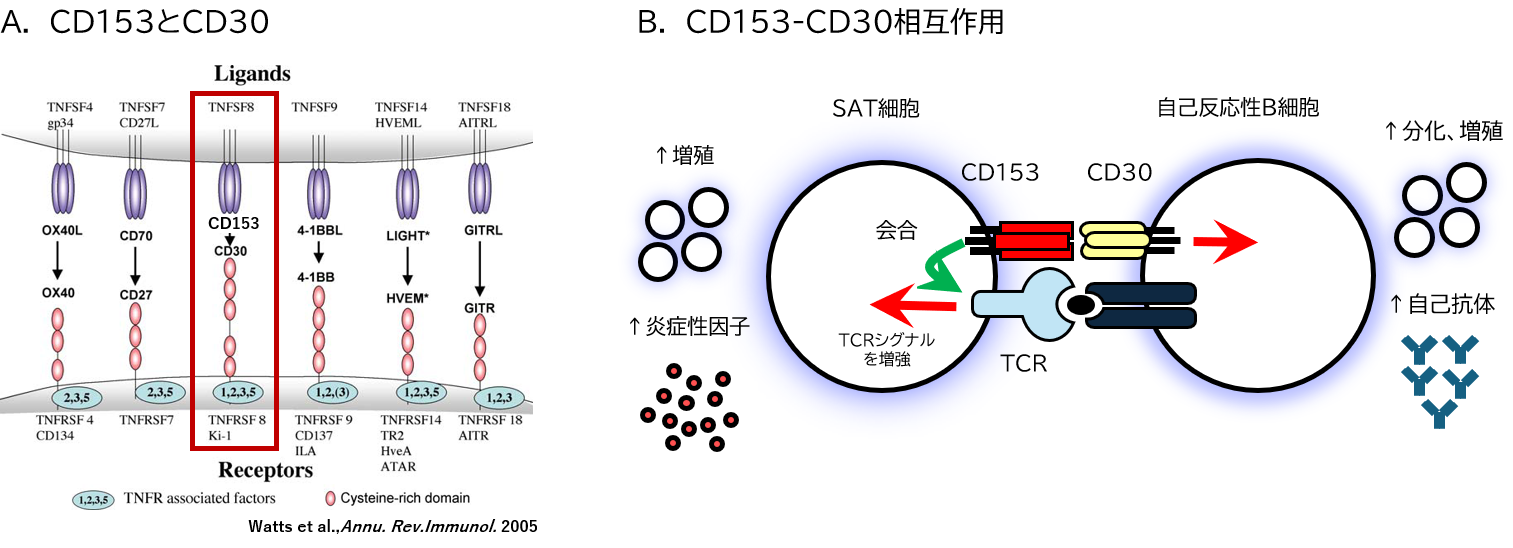
資料:図4-AはWatts et al., Annu. Rev. Immunol. 2005, 図4-Bは著者作成
図4 CD153-CD30相互作用によるSAT細胞と自己反応性B細胞の増殖ループ
1章で述べたように、加齢とともに免疫機能が低下するにも関わらず自身(正常な細胞)を攻撃するという、自己免疫状態(自己抗体量の増加など)に陥る傾向が増加する。若齢マウスと加齢マウス(ヒトでいうと40〜60歳に当たる)の血中に存在する自己抗体量を調べてみると、明らかに加齢マウスで増加している。しかし、CD153あるいはCD30を遺伝学的に欠損させたマウスでは、加齢マウスでも血中自己抗体量の増加が起きなかった。この結果はCD153およびCD30が加齢に伴う自己抗体産生に必須であり、その相互作用を阻害することにより自己免疫応答を抑制できるという可能性を強く示唆した。この知見はわれわれにCD153-CD30相互作用阻害抗体の作製を強く促した。
CD153-CD30相互作用阻害抗体の話に入る前に、少しSAT細胞の局在(生体内でどこに存在しているか)ということと疾患の関連性について述べてみたい。
CD4+細胞(ヘルパーT細胞)は前述したようにB細胞と相互作用し、B細胞の分化・増殖を制御し抗体産生を促す。この相互作用は脾臓(ひぞう)やリンパ節といった2次リンパ組織と呼ばれる臓器で行われ、顕微鏡下で観察すると胚中心 (Germinal Center: GC)と呼ばれる構造体が形成されているのが確認できる。マウスに外部から抗原を与えて免疫反応を起こさせると、胚中心が2次リンパ組織内で多数形成される。その場所でB細胞とT細胞が直接情報のやりとりを行い、B細胞は抗体産生細胞(形質細胞と呼ばれる)や記憶型B細胞に分化する。胚中心でB細胞との相互作用を担うCD4+ T細胞は濾胞(ろほう)性ヘルパーT細胞(follicular helper T cell:TFH)と呼ばれる。SAT細胞もTFH細胞と同じくその胚中心に局在する。しかし、抗原を免疫して形成される「抗原特異的胚中心」にはSAT細胞は局在せず、加齢とともに形成される「自己応答性胚中心」にのみ局在した(図5)。この胚中心は自己抗体を産生する自己反応性B細胞の分化の場と考えられているが、そこにSAT細胞が存在していた。自己応答性胚中心は全身性エリテマトーデス(SLE)などの自己免疫疾患モデルマウスで多く観察される。実際、SLEモデルマウスの2次リンパ組織を採って解析すると多数のSAT細胞が存在していた。またその増加は正常マウスに比べ早い時期から起こることもSLEモデルマウスの解析から明らかとなった。これらの結果はSLEなどの自己免疫疾患にSAT細胞が関与している可能性を示唆するものであった。
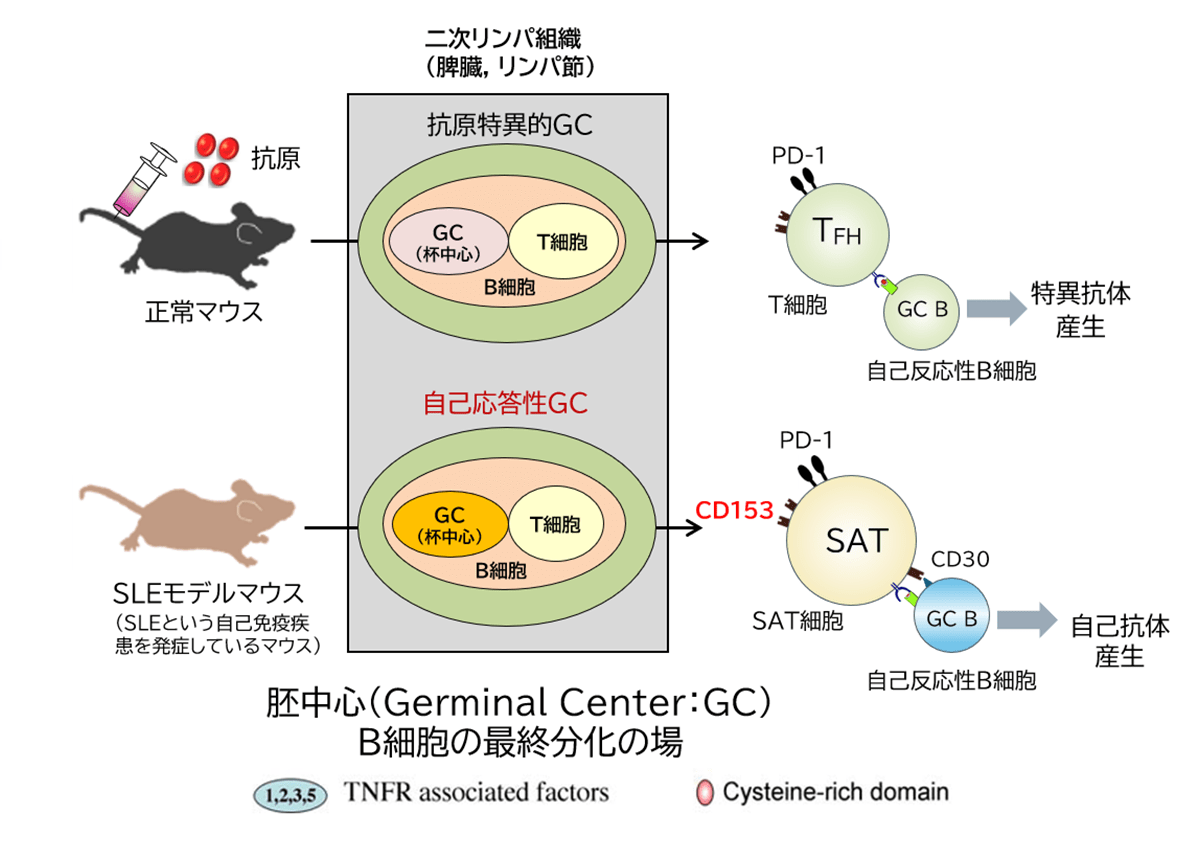
資料:著者作成
図5 SAT細胞の局在と自己抗体産生への関与
SLEは、自己細胞由来の核成分(DNA,ヒストンやRNA結合タンパクなど)に対して作られた大量の自己抗体が核成分と複合体を形成し、血管壁や腎臓の糸球体などに沈着し、血管炎や糸球体腎炎といった炎症を引き起こす。これらの自己抗体産生にSAT細胞がCD153-CD30相互作用を介して関与しているとしたら、それをブロックする抗体はSLEの発症を抑制する可能性がある。この可能性を確認するため、われわれは新たに強いCD153-CD30相互作用阻害活性を有する抗体を作製し、SLE発症に対する効果を調べる実験を行った。図6はその阻害活性を有する抗体をSLEモデルマウスに投与した結果を示している。今回用いたSLEモデルマウスは生後20週齢を過ぎたころから血中自己抗体量が増加し、30週齢を過ぎたころに尿タンパク(腎臓内炎症のマーカー)の上昇が見られるようになる。その時の腎臓を観察すると、糸球体に多数の免疫複合体沈着が観察される。その発症過程はヒトのSLE病態に酷似する。このマウスに作製した抗CD153抗体を投与したところ、2本鎖DNAを認識する自己抗体の産生が有意に抑制された。またその時のマウスの腎臓を観察したところ、対照群のマウス(IgG)で観察される糸球体への免疫複合体沈着が、抗CD153抗体を投与したマウス(17D)ではほぼ完全に抑制されていた。抗体を投与したマウスの脾臓を取り出し、SAT細胞および自己反応性B細胞について解析したところ、両者(自己抗体と免疫複合体)の大幅な減少が観察された。さらに治療プロトコールとして、2本鎖DNAに対する自己抗体が高値(1,000U/mL以上)を示すマウスを集め抗体の投与実験を行ったところ、ヒトSLE治療薬として用いられているミコフェノール酸モフェチル(Mycophenolate Mofetil:MMF)で治療したマウスに匹敵するほど、腎機能ならびに生存率が改善した(図7)。
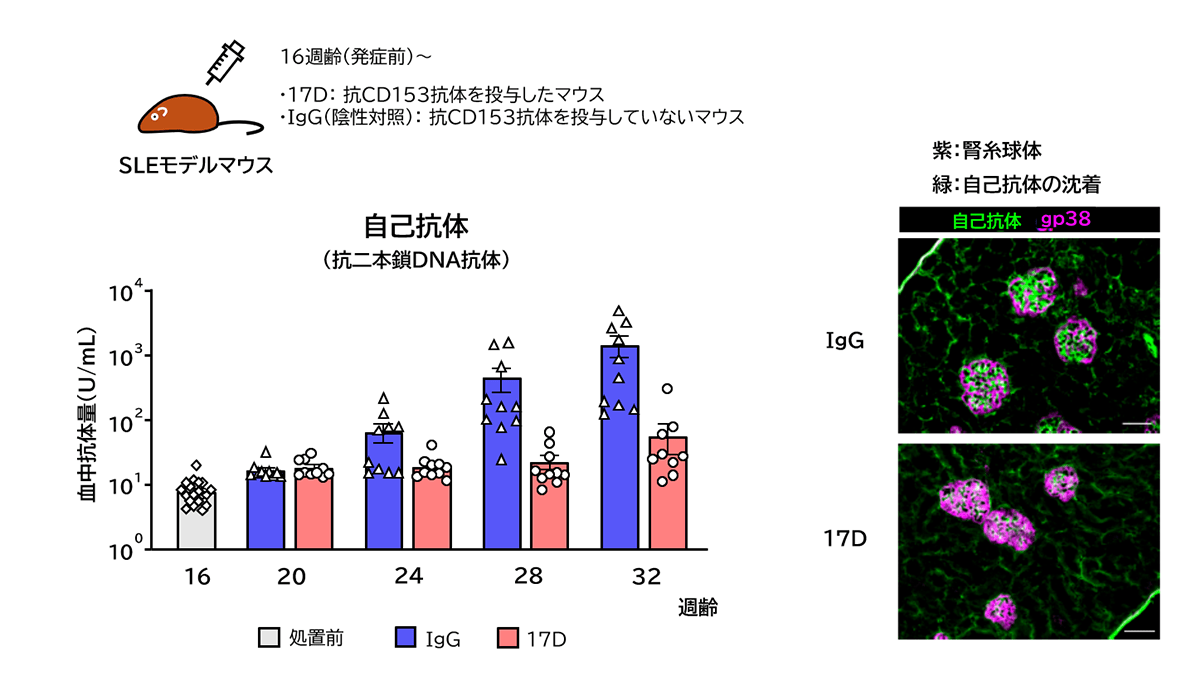
資料:Fukushima et al, Cell Reports, Vol.40, Issue 12, 111373, (2022)に基づき著者作成
図6 CD153-CD30相互作用阻害抗体の予防的投与実験
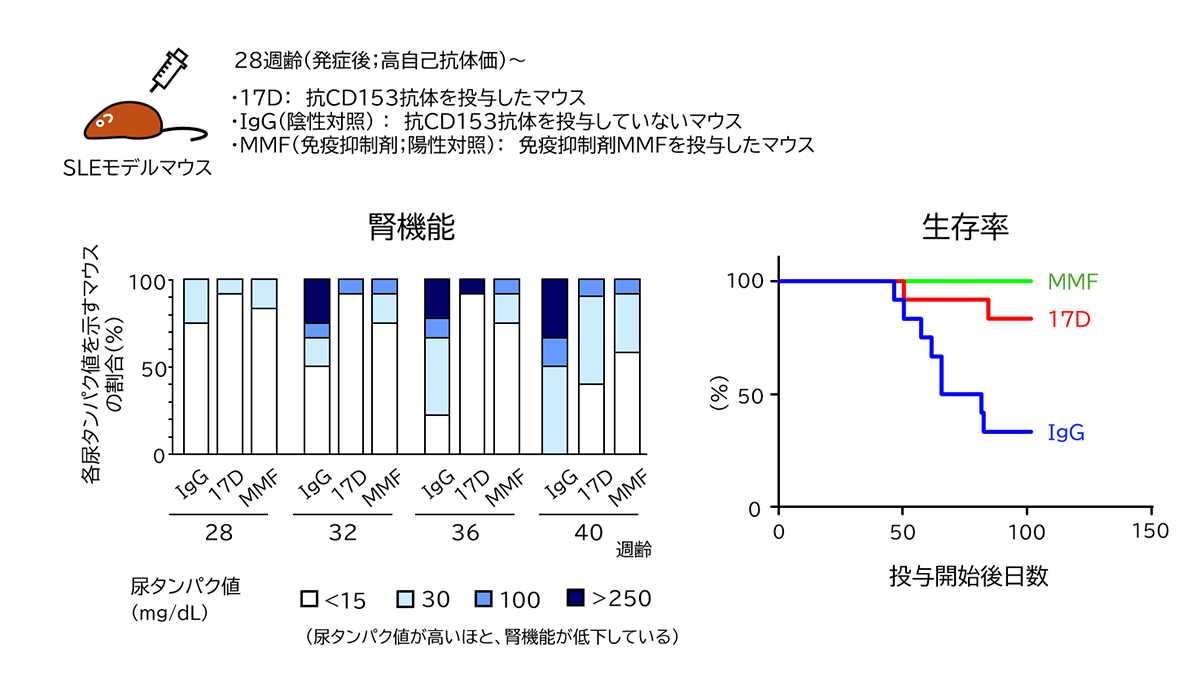
資料:Fukushima et al, Cell Reports, Vol.40, Issue 12, 111373, (2022)に基づき著者作成
図7 CD153-CD30相互作用阻害抗体の治療的投与実験
ヒトSLEでは、自己抗体の産生ならびに産生された自己抗体と対応抗原から形成される免疫複合体による炎症を抑制するため、ステロイドやMMFといった免疫抑制剤が治療薬として用いられている。最近では副作用軽減をめざし、B細胞の分化経路を抑制する抗体薬が開発され、臨床に用いられるようになってきた。しかし、いずれもB細胞機能が大幅に抑制されることから、外来の抗原に対する抗体産生までも抑制されるという副作用は避けられない。今回われわれが用いた抗CD153抗体は、外来抗原に対する抗体産生にほとんど影響を与えず、自己抗体産生のみが抑制されるという結果が得られている。免疫抑制効果がある治療薬は妊婦への使用制限がかけられるなど、治療効果が限定されていたが、抗CD153抗体をSLE治療薬として開発することにより、副作用のない治療薬が創出できる可能性が高いことが判明した。
自己抗体を特徴とする自己免疫性疾患には、SLEの他にシェーグレン症候群(Sjogren Syndrome:SjS)、全身性硬化症(Systemic Sclerosis:SSc)あるいは関節リウマチ(Rheumatoid Arthritis:RA)といった疾患があるが、これらはすべてその発症にI型インターフェロンと呼ばれるサイトカインが関与し、内的・環境的な増悪因子を共有している可能性が示唆されている。興味深いことに、SjS様症状を示すモデルマウスの唾液腺には、SAT細胞が蓄積し病態発症に関与することが報告されている。一方、前述のようにCD153はCD30に結合しシグナルを伝達するが、この結合が起こるとCD30が切断され、可溶型CD30(sCD30)として細胞外に放出される。SLE、SjS、SSc、RA患者の血清を調べてみると、このsCD30濃度は健常人より高く、各疾患の状態と相関していた。このことは、自己免疫疾患患者の生体内でCD153-CD30相互作用が起こった可能性を示唆している。
SAT細胞が発症に関与するその他の自己免疫疾患としては、多発性硬化症(Multiple Sclerosis:MS)が上げられる。MSは中枢神経系(Central Nervous System:CNS)の脳と脊髄に炎症を引き起こし、脱髄、軸索損傷および神経細胞消失をもたらす。MS患者のCNSには、活性化T細胞、B細胞、マクロファージやグリア細胞などの細胞の浸潤*13が見られ、その病態は加齢によって影響を受ける。一般にMSは若い女性に発症し再発と寛解*14を繰り返すが、最終的には多くの患者は何年もかけて神経症状が悪化する進行型の経過をとるようになる。一方、高齢者において発症した場合は、発症時から進行型に移行しやすい。MSの動物モデルである実験的自己免疫性脳脊髄炎(Experimental Autoim- mune Encephalomyelitis:EAE)発症マウスを用いた解析から、高齢マウスでは若年マウスよりも重篤な経過をたどることが明らかとなった。さらに、重篤な EAE を発症した高齢マウスでは、中枢神経系において SAT細胞が顕著に増加していた。また、このEAEモデルマウスに抗CD153抗体を投与するとその症状が緩和することも明らかになっている。
ここまでSAT細胞と自己免疫疾患との関連性について述べてきたが、SAT細胞がその発症に関与している可能性がある疾患は自己免疫疾患だけにとどまらない。加齢とともに全身性慢性炎症が起こりやすくなり、その程度は多疾患併存率や死亡率と相関することが知られている。加齢と同様にさまざまなタイプの組織ストレスにより多臓器で組織炎症が起こり、そこにSAT細胞が関与している可能性があることも、最近明らかになってきている。例えば高脂肪食(High Fat Diet:HFD)摂取により炎症性内臓脂肪組織(Visceral Adipose Tissue:VAT)が増加し、2型糖尿病の発症リスクが上昇することはよく知られているが、この代謝ストレスによりVAT内にSAT細胞が増加・蓄積することが慶応大学医学部循環器内科のグループから報告されている。VAT内に増えたSAT細胞から産生される炎症性サイトカインOPNにより、さらなる炎症性サイトカイン遺伝子やマクロファージの組成変化が誘導され、VAT炎症の増悪化を引き起こすことが明らかにされた。興味深い点は、肥満によって誘導されたSAT細胞は、ダイエットにより体重が正常化した後もVATにそのまま存在し続け、持続的な炎症源となっていることである。
老年期における慢性腎臓病(Chronic Kidney Disease:CKD)の発症にSAT細胞が関与している可能性も報告されている。さまざまな原因により急性腎障害(Acute Kidney Injury:AKI)が起こると、若年者の場合、修復が速やかに行われ腎臓機能が正常に戻る。これに対して高齢者の場合、いったんAKIが起こると修復されることなくCKDや末期腎不全に移行する傾向が高い。京都大学医学部の腎臓内科のグループは、マウスを用いた実験から、高齢マウスでは虚血性腎障害および腎症性腎障害によって誘発されたAKIはほとんど修復されず、最終的には腎臓組織内に3次リンパ様構造(Tertiary Lymphoid Structure:TLS)と呼ばれる2次リンパ組織によく似た構造体が形成されることを見いだした。そしてこのTLSにSAT細胞ならびにCD30+自己反応性B細胞が集積することを明らかにした。さらに、高齢マウスでCD153またはCD30のいずれかを遺伝子操作により欠損させると、AKI後のTLSの発生が抑制され、組織の炎症、臨床症状、腎機能が改善した。このことは、AKIからCKDへの病態の開始と悪化において、SAT細胞とCD30+自己反応性B細胞との間のCD153-CD30相互作用が重要な役割を果たしていることを強く示唆している。これらの所見を総合すると、SAT細胞は対応するB細胞亜集団とともにストレスのかかった組織で増殖し、慢性炎症性疾患の発症、進行、持続の原因となる組織の炎症を悪化させる可能性があることが分かる。
以上、SAT細胞が発症に関与していると考えられる疾患を挙げてきたが、これらの疾患はいずれも最初に上げた加齢関連疾患に含まれている(図1B)。つまり、SAT細胞を制御する方法を見つけることができれば、SLEなどの自己免疫疾患だけではなく、さまざまな加齢関連疾患を治療できる可能性があることが示唆される。CD153-CD30相互作用を阻害する抗体はその第一候補となる。
2016年、米国のBakerらによりNature誌に驚くべき論文が発表された。彼らは遺伝子改変により細胞周期阻害物質であるp16Ink4a陽性の老化細胞*15だけを選択的に除去できる仕組みをマウスに導入して実験したところ、生存期間が50%延長できることを見いだした。このマウスでは寿命延長の他、がんや心臓疾患の発症も有意に減少していた。その後、この論文について追試が行われ、マウス飼育環境によって結果が大きく左右されるものの、老化細胞除去が老化に伴うさまざまな事象を抑制する有効手段であることが確認されている。ゾンビ細胞とも呼ばれる老化細胞の除去は“Senolytics”と呼ばれる研究分野の確立に至り、老化細胞除去薬の開発競争へとつながっている。この老化細胞除去薬の開発には多くの企業・ベンチャーが参入し、すでに臨床治験の段階に来ている。生理現象であったはずの「老化」が「病気」として認識され、その治療薬開発へ舵(かじ)が切られたのである。
これまで述べてきたSAT細胞研究の最大の問題は、マウスを使った解析が主となっており、ヒトのデータが少ないということである。SAT細胞の研究を紹介すると、例外なく「ヒトにもSAT細胞が存在し、加齢関連疾患の発症に関与しているのか」という疑問が投げかけられるが、残念ながらその問いに対しいまだ自信を持って「Yes」という返事ができないでいる。ヒトでのSAT細胞の解析を遅らせている最大の原因は、先に説明したSAT細胞の特徴的な局在性にある。通常、T細胞やB細胞といった免疫細胞は、末梢血中に出て体中を循環し、その機能を果たしている。そのためこれらの細胞の状態を調べるには末梢血を採血すれば解析が可能となる。しかし、SAT細胞は2次リンパ組織に形成される胚中心に局在し、末梢血中には存在しない。そのため、ヒトではがんなどの手術の際、摘出された臓器を使って解析する他その存在を調べるすべがない。それでも最近、臓器の中に存在する免疫細胞の情報をSingle Cell RNA Sequence(scRNAseq)により解析・収集する手法が開発され、そのデータが多くの公共データベースに登録されるようになった。われわれもそういったデータベースを用いてSLE患者のリンパ組織における解析を行ったところ、SAT細胞と考えられるCD153+PD-1+CD4+T細胞がSLEの患部組織に多数存在することを確認できた。さらにその数はSLE病態と密接に相関することも見いだしている。これからさらにscRNAseqデータが蓄積されれば、多くの疾患とSAT細胞の関連性について解析することが可能になると考えられる。
付け加えると、カニクイザルを用いた研究から「霊長類にはSAT細胞は間違いなく存在する」ことが確認できている。SLEの発症に自己抗体が重要な役割を果たしていることはすでに述べたが、この自己抗体産生に自然免疫の活性化に関わるトル様受容体(Toll-Like Receptor:TLR)と呼ばれる受容体*16の一つ、TLR7が深く関与していることがモデルマウスやSLE患者の解析から明らかになっている。正常マウスを用いた実験でこのTLR7を刺激する物質(TLR7リガンド)を投与すると、自己抗体の産生や糸球体腎炎といったSLE様病態が再現できることが報告されている。そこでこの実験系を応用しカニクイザルにTLR7リガンドを投与したところ、2本鎖DNAに対する自己抗体の産生が確認できると同時に、脾臓にはSAT細胞と同じ細胞表面マーカー*17を発現するCD4+T細胞が増加しているのを確認できた。そしてそのT細胞はやはり脾臓に形成された胚中心に局在していた。
SAT細胞あるいは老化細胞を標的とした医療を行う上で重要なポイントは、治療対象とする患者生体のどこにどのくらい老化細胞が存在し、その老化度はどの程度であるかをいかに知るかという点である。細胞や臓器を取り出し、それらを解析するのは当然であるが、そういった方法ではなく非侵襲でその情報が得られるようになったときに、初めて老化研究の本当の扉が開かれるのではないかとひそかに考えている。そのためには理工学的手法が重要であり、またDX(Digital Transformation)がその方向性を決めるかもしれない。老化細胞のミトコンドリアの膜電位が正常細胞に比べ大幅に変化することが知られているが、そのような老化に伴う細胞レベルの物理学的変化を測定できる方法が開発できれば、非侵襲データによる老化研究も夢物語ではない。
本稿ではこれまで、加齢に伴い増加するSAT細胞の制御を通した健康寿命の延長について論じてきた*18。ここで、改めて加齢関連の疾患対策と健康寿命の延長をいかに実現するかを考えたとき、そこには別の論点があることにも触れておきたい。それは、老化により低下する運動機能と認知機能への対応である。運動機能については、まずこれを何らかの方法で補完する必要がある。さらに認知機能については、アルツハイマー病をはじめとする認知症対策がいまだ研究途上にあり、有効な方途の確立にはかなりの時間を必要とするが、その成果に期待したい。加齢関連疾患に加え、運動・認知機能の両方の問題を解決したときに「真の超高齢化社会」が到来する。
健康寿命延長によりもたらされる「真の超高齢化社会」を、経済・産業・社会システムの観点で見ると、それはどのようなものになるのであろうか。超高齢化社会がもたらす変化として、まず医療費や介護費の軽減と高齢者の社会参加の拡大が挙げられる。後者は経験豊富な人材の活用につながり、人口減少に伴う企業活動の低下を補うことができる可能性が高い。また高齢者の消費活動が活発化することによって、経済が活性化する可能性もある。さらに健康な高齢者が増えることにより、家族や地域コミュニティにおいて多世代がともに生活し、互いに助けあう新しいコミュニティモデルが生まれるかもしれない。一方で、健康な高齢者の労働参加により、若年層の雇用機会やキャリア形成に大きな影響が及ぼされることは避けられないであろう。また、健康な高齢者の増加は都市インフラや交通システム、あるいは公共サービスのデザインの変化を必要とする。こうした新たな社会的課題に対する解決策について、健康寿命延長をもたらす医療技術の開発や超高齢化社会に対応する企業イノベーションを推し進めることと並行して、政策面の見直しを進める努力が必要となるであろう。

服部 雅一(はっとり まさかず)
京都大学大学院 医学研究科 がん組織応答共同研究講座 特任教授
1983年、北海道大学獣医学研究科修士課程修了。1992年、同大博士(獣医学)。
1997年、京都大学大学院医学研究科・免疫細胞生物学教室 助手。その後、免疫老化学共同研究講座、がん組織応答共同研究講座などの特定教授を歴任(2024年より特任教授)。T細胞老化については、2005年ごろから湊 長博教授(現・京大総長)と研究を開始。2009年に最初の論文を発表。その後研究を継続し、現在に至る。
執筆者紹介

服部 雅一
京都大学大学院
医学研究科
がん組織応答共同研究講座
特任教授
機関誌「日立総研」、経済予測などの定期刊行物をはじめ、研究活動に基づくレポート、インタビュー、コラムなどの最新情報をお届けします。
お問い合わせフォームでは、ご質問・ご相談など24時間受け付けております。